- Zhong Shen (Shanghái): 20 a?os de experiencia como su agente de comercio exterior.
- +86 139 1787 2118
Este artículo analiza en detalle las exportaciones.Equipos MédicosLos requisitos de certificación y los procedimientos necesarios para India, incluyen: la autoridad reguladora de dispositivos médicos en India, la clasificación de dispositivos médicos, la solicitud de licencia de fabricación de dispositivos médicos para exportación a India, las regulaciones de etiquetado de dispositivos médicos, y los pasos específicos del proceso de exportación de dispositivos médicos a India.
índice
ToggleI. El organismo regulador de dispositivos médicos en la India
La regulación de dispositivos médicos en India está a cargo de la Central Drugs Standard Control Organization (CDSCO), dependiente del Ministerio de Salud y Bienestar Familiar (Ministry of Health & FW). Dentro de esta organización, el departamento clave es el Controlador General de Medicamentos de India (The Drug Controller General of India, DCGI), responsable de establecer las políticas nacionales sobre dispositivos médicos.
II. Clasificación de dispositivos médicos
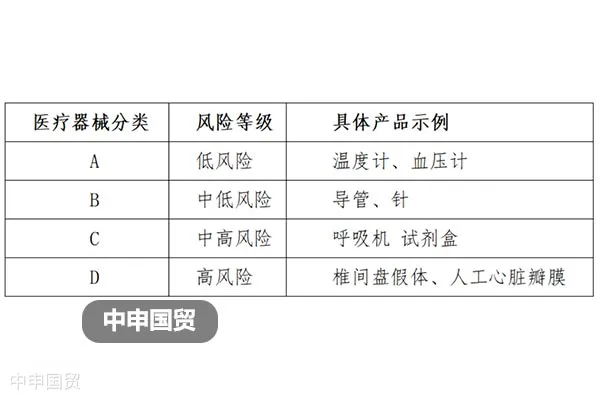
En 2017, India publicó las "Reglas de Dispositivos Médicos 2017" (Medical Device Rules 2017), tomando como referencia el Grupo de Trabajo para la Armonización Global (The Global Harmonization Task Force, abreviado como GHTF), y clasificó los dispositivos médicos en cuatro categorías de la A a la D, correspondientes a niveles de riesgo de bajo a alto.
III. Solicitud de licencia de fabricación de dispositivos médicos para exportación a India
Los dispositivos médicos exportados a la India deben pasar por un representante autorizado local en la India para presentar una solicitud de licencia de importación de dispositivos médicos al CDSCO. El proceso de solicitud incluye principalmente los siguientes dos pasos:
Confirmar la conformidad del Sistema de Gestión de Calidad (Quality Management System, QMS) del fabricante: En primer lugar, el CDSCO revisará el QMS del fabricante presentado por el representante autorizado, el cual debe cumplir con el estándar indio de gestión de calidad para dispositivos médicos ICMED 13485 (adaptado de la norma ISO 13485; el estándar nacional chino YY/T 0287 es equivalente a ISO 13485). Esta revisión incluye la documentación técnica del QMS del fabricante, los informes de pruebas y el informe de la última inspección in situ, entre otros. Si el CDSCO considera que existen dudas sobre la conformidad del QMS del fabricante, puede solicitar una evaluación, pruebas del producto o una inspección in situ en las instalaciones del fabricante (los costos serán cubiertos por el representante).
Evaluación de la seguridad y eficacia de dispositivos médicos: Si la clasificación del dispositivo médico exportado a India pertenece a la Clase A o B, el representante autorizado debe presentar a la CDSCO un Certificado de Venta Libre de China o datos de pruebas clínicas realizadas en China (u otros datos que demuestren la seguridad y eficacia del producto). Si la clasificación del dispositivo médico exportado a India pertenece a la Clase C o D, el representante autorizado debe realizar pruebas clínicas en India. Excepción: Si el dispositivo médico (Clase A a D) ya cuenta con un Certificado de Venta Libre emitido por las autoridades reguladoras de la Unión Europea, Estados Unidos, Canadá, Japón o Australia, no se requerirán pruebas clínicas adicionales.
El proceso de solicitud de licencia requiere un trabajo meticuloso y preciso, que incluye la preparación y presentación de un conjunto completo de documentos, el seguimiento y resolución de posibles problemas, así como la gestión de posibles inspecciones y evaluaciones in situ. Durante todo el proceso, mantener una buena comunicación e interacción con la CDSCO es fundamental para garantizar que el procedimiento avance sin contratiempos. Al mismo tiempo, contar con un conocimiento profundo de las regulaciones de dispositivos médicos en la India es un factor clave para asegurar el éxito de la solicitud.
IV. Etiquetado de dispositivos médicos
El "Reglamento de Dispositivos Médicos de la India 2017" tiene regulaciones estrictas sobre el etiquetado de dispositivos médicos. Los artículos 44 al 48 especifican el contenido obligatorio de las etiquetas:
(1) Nombre del dispositivo médico
(2) Los detalles necesarios para la identificación del usuario y el uso del equipo
(3) El nombre del fabricante y la dirección del lugar de fabricación donde se fabricó el equipo.
(4) La descripción precisa de la cantidad neta debe expresarse en unidades métricas, ya sea por peso, dimensiones, volumen, número de unidades (según corresponda) y la cantidad de equipos contenidos en el empaque.
(5) Fecha de producción y período de validez (o la etiqueta debe indicar la vida útil del producto).
(6) Proporcionar indicaciones cuando sea necesario, para indicar que el dispositivo contiene sustancias medicinales o biológicas.
(7) Proporcionar un número de lote visible, comenzando con la palabra "Lot No." o "Lot" o "Batch No." o "B.No."
(8) Indicar, cuando sea necesario, cualquier condición especial de almacenamiento o manejo aplicable al equipo.
(9) Indicar si el dispositivo se proporciona como producto estéril, así como su estado de esterilidad y método de esterilización.
(10) Dar una advertencia o medida preventiva (si se considera relevante) para llamar la atención del usuario del dispositivo médico.
(11) Si el dispositivo es de un solo uso, debe estar marcado adecuadamente.
(12) Si se planea distribuir dispositivos médicos como muestras gratuitas a profesionales de la salud, se debe imprimir en la etiqueta del dispositivo la leyenda "Muestra para médico—No se puede vender".
(13) Excepto para equipos importados, agregue el número de licencia de fabricación antes de "Manufacturing Licence Number" o "Mfg. Lic. No." o "M.L".
(14) En caso de equipos importados, se proporcionarán en la etiqueta mediante adhesivo (si aún no están impresos) dichos detalles, incluyendo: número de licencia de importación, nombre y dirección del importador, dirección del lugar real de producción y fecha de fabricación.
(15) Si los dispositivos médicos peque?os no pueden imprimir claramente toda la información debido a su tama?o, al menos deben incluir la información necesaria para la identificación del producto y la seguridad.
V. Pasos del proceso para exportar dispositivos médicos a la India
Los pasos generales para exportar dispositivos médicos a la India incluyen:
(1)Conoce los requisitos regulatorios de la India:Investigar y comprender las regulaciones y requisitos de la India sobre la exportación de dispositivos médicos, incluyendo registro, licencias, requisitos de etiquetado, estándares de control de calidad, etc.
(2)Registro y certificación:Registrar y certificar en la India para demostrar que el producto cumple con los estándares locales de seguridad y calidad. Puede ser necesario obtener un certificado de registro emitido por la Autoridad de Dispositivos Médicos de la India (Medical Devices Authority of India).
(3)Preparar documentos y materiales:Preparar los documentos y materiales para respaldar la solicitud de exportación, como el manual del producto, certificado de garantía de calidad, informe de pruebas del producto, certificado de permiso de producción, certificado de registro, etiquetas del producto, certificado de registro de la empresa,Importación y exportaciónLicencias, etc.
(4)Consulta y representación:Considere trabajar con una empresa consultora o agencia con experiencia en India, ya que pueden brindar orientación profesional y manejar los procedimientos y trámites documentales complejos.
(5)Llenar la solicitud y presentar los documentos:De acuerdo con los requisitos de las autoridades pertinentes de la India, complete la solicitud de exportación y presente los documentos y materiales requeridos. Asegúrese de que la información proporcionada sea precisa y envíe la solicitud a tiempo.
(6)Revisión y aprobación:Las autoridades pertinentes de la India revisarán la solicitud y los documentos presentados, y podrán realizar inspecciones, pruebas y evaluaciones para confirmar que el producto cumple con los estándares y requisitos. Una vez aprobada la revisión, se otorgará la aprobación de exportación.
(7)Cumplir con los requisitos del país importador:Además de los requisitos de exportación de la India, también es necesario comprender y cumplir con los requisitos de importación del país de destino, lo que puede involucrar aspectos como el despacho de aduanas, aranceles, impuestos, licencias de importación, entre otros.
Los pasos anteriores pueden variar según el tipo de producto, el país y los cambios en las regulaciones, por lo que antes de exportar, se recomienda buscar asesoramiento profesional o comunicarse con las instituciones comerciales locales para garantizar que se cumplan todos los requisitos necesarios.
Recomendaciones relacionadas
- ?Qué desafíos se pueden encontrar al exportar productos plásticos médicos como agente? ?Cómo elegir un proveedor de servicios comerciales que cumpla con las regulaciones?
- ?Equipo médico de clase II importado de Alemania, estos puntos clave debes conocer!
- Importación de equipos médicos de alta gama japoneses: análisis de procesos de comercio exterior y oportunidades
- Importación de equipos médicos de alta gama: análisis completo y estrategias para el proceso de comercio exterior
- ?Estos son los puntos clave que debes saber al importar termómetros electrónicos desde Alemania!
? 2025. All Rights Reserved.










